树状分类法:根据物质的组成对物质进行分类的方法
交叉分类法:从不同的角度对物质进行分类的方法
二.几组定义
纯净物:由单一物质组成的物质。注:由同位素原子组成的物质是纯净物, 如 H2O和D2O混合后仍是纯净物。
单 质:由同种元素组成的纯净物。
化合物:由不同种元素组成的纯净物。
氧化物:由两种元素组成,其中一种元素是氧的化合物。
酸性氧化物:能与碱作用只生成一种盐和水的氧化物(注意"只"字)。非金属氧化物多数是酸性氧化物,某些过渡元素的高价氧化物(如CrO3、Mn2O7等)也是酸性氧化物。酸性氧化物属于酸酐,例如SO2叫亚硫酐,SO3叫硫酐,CO2叫碳酐,醋酸酐是酸酐但不是酸性氧化物。酸性氧化物对应的水化物是含氧酸,如SO3对应的水化物是H2SO4,CO2对应的水化物是H2CO3,SiO2对应的水化物是H2SiO3等。酸性氧化物多数能跟水直接化合生成含氧酸,少数酸性氧化物(SiO2)不能直接跟水反应。酸性氧化物一般由非金属直接氧化或含氧酸、含氧酸盐受热分解制得。注意:酸性氧化物中大多数是非金属氧化物。非金属氧化物中大多数是酸性氧化物。含氧酸才有酸性氧化物。CO、NO,NO2不是酸性氧化物。
碱性氧化物:与水反应只生成碱,或与酸反应只生成盐和水的氧化物(注意"只"字)。金属氧化物一般为碱性氧化物,但有例外,比如CrO3、Mn2O7是酸性氧化物。大多数金属氧化物是碱性氧化物,可以说碱性氧化物一定是金属氧化物,但不能说金属氧化物一定是碱性氧化物,如Na2O2,Fe3O4是金属氧化物但不是碱性氧化物。
酸:电离出阳离子全部是H+的化合物
碱:电离出阴离子全部是OH-的化合物
盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物
正盐:既不含能电离的氢离子,又不含氢氧根离子的盐
酸式盐:电离时生成的阳离子除金属离子(NH4+)外还有氢离子,阴离子为酸根离子的盐。
碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐。
复盐:两种金属离子(或NH4+)和一种酸根离子构成的盐。例如KAl(SO4)2等。
混盐:由一种金属阳离子(包括NH4+)和两种酸根阴离子所组成。例如氯化次氯酸钙CaOCl2 等。
元素:具有相同的核电荷数的一类原子的总称。它主要用来描述物质分子的化学组成,只强调种类,而不表示个数,没有数量多少的含义。
同素异形体:同样的单一化学元素组成,但性质却不相同的单质。(同一元素因为排列方式不同而产生不同的物理性质与化学性质。)同素异形体之间的性质差异主要表现在物理性质上,化学性质上也有着活性的差异。同素异形体之间在一定条件下可以相互转化,这种转化是一种化学变化。
三.溶液、胶体、浊液三种分散系的比较:
四.关于胶体
分散质:分散系中被分散成粒子的物质。
分散剂:促使物料颗粒均匀分散于介质中,形成稳定悬浮体的药剂。
分散系:把一种或几种物质以粒子形式分散在另一种物质中所形成的体系。
胶体是一种特殊的分散系。按分散剂的不同,胶体分为气、液、固溶胶。
胶体的鉴定:方法是丁达尔效应。具体操作是:用一束可见光照射液体,可以看到一条光亮的“通路”,为胶体。丁达尔效应利用的是光的散射原理,其实溶液也能发生光的散射,但散射及其微弱,看不到光亮的通路。
常见的胶体:云、雾、泥土、江水、湖水、河水、牛奶、豆浆、淀粉溶液、烟水晶等。
五.氢氧化铁胶体的制备

①制备方法为水解法。②方程式为
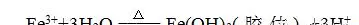
③FeCl3用量很少,如果加入过多,可能产生沉淀;加热到液体出现红褐色,停止加热,如果继续加热,也可能产生沉淀。④向Fe(OH)3胶体中加入稀H2SO4,现象是先有沉淀产生,后沉淀逐渐溶解。
六.胶体的补充知识
1.胶体由于分散质粒子直径在1 nm~100nm之间,表面积大,因而表现出下列特性:
①有强的吸附能力—明矾的净水;
②能透过滤纸而不能透过半透膜 —用于悬浊液、胶体、溶液的分离;
③丁达尔效应—鉴别溶液和胶体;
④布朗运动—胶体能均一、较稳定地存在的原因之一;
⑤电泳现象—胶粒对溶液中的离子发生选择吸附,使胶粒带同种电荷。这是胶体能稳定存在的主要原因。
2.胶粒带电规律
一般来讲金属氧化物及其水化物形成的胶体粒子带正电荷;非金属氧化物及水化物、金属硫化物形成的胶体粒子带负电荷。
3.胶体的聚沉方法及应用
①加热—加速胶体粒子运动,使之易于结合成大颗粒;
②加入电解质——中和胶粒所带电荷,使之聚结成大颗粒;
③加入带相反电荷的胶体——互相中和电性.减小同种电荷的相互排斥作用而使之聚集成大颗粒;
4.应用
①农业生产:土壤的保肥作用.土壤里许多物质如粘土,腐殖质等常以胶体形式存在.
②医疗卫生:血液透析,血清纸上电泳,利用电泳分离各种氨基酸和蛋白质.13
③日常生活:制豆腐原理(胶体的聚沉)和豆浆牛奶,粥,明矾净水.
⑤自然地理:江河人海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉.
⑤工业生产:制有色玻璃(固溶胶),冶金工业利用电泳原理选矿,原油脱水,工业除尘等.
⑥国防工业的火药、炸药常制成胶体。
⑦石油原油的脱水、工业废水的净化、建筑材料中的水泥的硬化,都用到胶体的知识。
七.几组定义
蒸馏:利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的单元操作过程。
分馏:是分离几种不同沸点的混合物的一种方法,分馏实际上是多次蒸馏,它更适合于分离提纯沸点相差不大的液体有机混合物。如煤焦油的分馏;石油的分馏。当物质的沸点十分接近时,约相差25℃,则无法使用简单蒸馏法,可改用分馏法。分馏柱的小柱可提供一个大表面积与蒸气凝结。
焰色试验:是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。
潮解:是某些物质(多指固体)从空气中吸收或者吸附水分,使得表面逐渐变得潮湿、滑润,最后物质就会从固体变为该物质的溶液的现象。
熔化:对物质进行加热,使物质从固态变成液态的过程。它是物态变化中比较常见的类型。熔化需要吸收热量,是吸热过程。晶体有一定的熔化温度,叫做熔点。非晶体没有一定的熔化温度。熔化的逆过程是凝固。
汽化:是指物质从液态变为气态的相变过程。
液化:物质由气态转变为液态的过程,气体液化时要放热。 实现液化有两种手段,一是降低温度,二是压缩体积。
干馏:是固体或有机物在隔绝空气条件下加热分解的反应过程。
升华:指固态物质不经液态直接变为气态。
显色反应:是将试样中被测组分转变成有色化合物的化学反应。
分解:是指由一种物质反应生成两种或两种以上新物质的反应,可以简单理解为“一变多”。
电解:是将电流通过电解质溶液或熔融态电解质,在阴极和阳极上引起氧化还原反应的过程。
水解:是利用水将物质分解形成新的物质的 过程。水解是盐电离出的离子结合了水电离出的氢离子和氢氧根离子生成弱电解质分子的反应。水解是物质与水发生的导致物质发生分解的反应(不一定是复分解反应)也可以说是物质与水中的氢离子或者是氢氧根离子发生反应。
裂解:物质受热发生分解的反应过程。中学一般指石油的裂解,是深度裂化。
氧化:物质失电子的反应,或有机物引入氧或脱去氢的反应。
风化:是指结晶水合物在常温和干燥空气的条件下,失去全部或部分结晶水的过程。
钝化:是指金属经强氧化剂或电化学方法氧化处理,使表面变为不活泼态即钝化的过程,是使金属表面转化为不易被氧化的状态,而延缓金属的腐蚀速度的方法。另外,一种活性金属或合金,其中化学活性大大降低,而成为贵金属状态的现象,也叫钝化。
催化:即通过催化剂改变反应所需的活化自由能,改变反应物的化学反应速率,反应前后催化剂的量和质均不发生改变的反应。
皂化:指动、植物油脂与碱作用而成肥皂(高碳数脂肪酸盐)和甘油的反应。
歧化:又称自身氧化还原反应,是化学反应 的一种,在同一个反应中同一个元素的不同原子化合价既有上升又有下降。 相同分子在一定条件下由于相互之间的原子(团)转移而生成两种不同分子的反应过程。
硝化:指有机化合物分子中引入硝基的反应。
酯化:是醇跟羧酸或无机含氧酸生成酯和水的反应。分为羧酸跟醇反应和无机含氧酸跟醇反应和无机强酸跟醇的反应三类。
裂化:是一种使烃类分子分裂为几个较小分子的反应过程。裂化反应可分为热裂化和催化裂化。
油脂的硬化:液态油在催化剂(如镍)存在并加热加压的条件下,可以跟氢气起加成反应。这种反应叫做油脂的氢化,也叫硬化,即为加氢硬化。
八.常见物质的俗名