第六单元 碳和碳的氧化物
01 思维导图
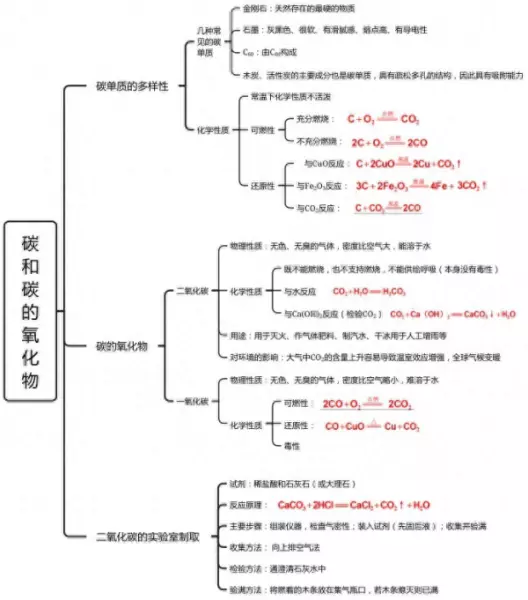
02 考点速记
课题1 碳单质的多样性
(一)碳的单质
1.金刚石、石墨和C60的结构、物理性质及性质存在差异的原因
物质 | 金刚石 | 石墨 | C60 |
结构模型 | |||
宏观组成 | 都是由碳元素组成的单质 | ||
构成物质的粒子 | 碳原子 | 碳原子 | C60分子 |
化学式 | C | C | C60 |
物理性质 | 外观 | 无色透明的固体 | 灰黑色的固体 |
光泽 | 加工后璀璨夺目 | 有金属光泽 | |
硬度 | 天然存在的最硬的物质 | 很软 | |
导电性 | 不导电 | 优良 | |
物理性质存在差异的原因 | 碳原子的排列方式不同 |
2.金刚石、石墨和C60的性质及用途
3.木炭、活性炭等的性质及用途
木炭(或活性炭)具有疏松多孔的结构,因此具有吸附能力。活性炭的吸附作用比木炭强,可用于吸附毒气、制糖工业中脱色制白糖、污水和饮用水的深度净化处理及吸附室内装修产生的有害气体等。
(二)碳单质的化学性质
1.在常温下,碳单质的化学性质不活泼(碳原子的最外层电子数为4,不易得失)
用途:用炭黑制成的墨书写绘画,档案用碳素墨水书写,木质电线杆埋入地下部分烤焦增强耐腐蚀性。
2.可燃性(碳单质与氧气反应)
3.还原性
(1)木炭还原氧化铜实验
木炭还原氧化铜实验装置 | 实验现象 | 实验结论 |
黑色粉末变成红色 | 实验现象说明反应生成了铜和二氧化碳,反应的化学方程式为C+2CuO 高温 2Cu+CO2↑。 | |
澄清石灰水变浑浊 | ||
实验分析 | ①在酒精灯上加网罩的目的:集中火焰,提高温度。 ②反应结束时,要先撤出导管,再停止加热的目的:防止石灰水倒吸入热的试管中,使试管炸裂。 ③用弹簧夹夹紧乳胶管后,要待试管冷却后再将粉末倒出:防止热的铜重新被氧化。 |
(2)碳与二氧化碳反应:C+CO2 高温 2CO(吸热反应)
课题2 碳的氧化物
(一)二氧化碳
1.二氧化碳的性质
(1)物理性质:无色,无味的气体,密度比空气大,能溶于水,固态二氧化碳叫干冰。
(2)证明二氧化碳物理性质实验
倾倒CO2 | CO2的溶解性实验 |
现象:下层蜡烛先熄灭,上层蜡烛后熄灭 | 现象:塑料瓶变瘪 |
分析:CO2的密度比空气大;不能燃烧,也不支持燃烧 | 分析:部分CO2溶于水中,使瓶内的气体减少,导致瓶内压强减小,大气压强使塑料瓶变瘪 |
(3)证明二氧化碳与水反应实验
实验 操作 | ||||
Ⅰ.喷水 | Ⅱ.放入CO2中 | Ⅲ.喷水后放入CO2中 | Ⅳ.吹干第三朵纸花 | |
现象 | 纸花不变色 | 纸花不变色 | 纸花变红 | 纸花由红色变成紫色 |
分析 | 水不能使紫色石蕊变红 | CO2不能使紫色石蕊变红 | CO2与水反应生成了酸性物质,使紫色石蕊变红 | 生成的酸性物质不稳定,受热易分解 |
结论 | CO2与水反应生成了碳酸,使紫色石蕊溶液变成红色CO2+H2O=H2CO3 | H2CO3∆H2O+CO2↑ |
(4)证明二氧化碳能与澄清石灰水反应
操作:将二氧化碳通入澄清石灰水中;现象:澄清石灰水变浑浊。
反应方程式:CO2+Ca(OH)2 = CaCO3↓+H2O(用于检验二氧化碳气体)
2.二氧化碳的用途
CO2的用途 | 依据的性质 |
①干冰(固体二氧化碳)作制冷剂。 用于食品冷藏、制造舞台雾景、人工降雨。 | 干冰升华吸热(物理变化) |
②灭火 | ①二氧化碳不能燃烧,②不支持燃烧,③密度比空气的大 |
③温室肥料(气肥),可以增大农作物的产量 | CO2是光合作用的原料,能促进光合作用 |
④制汽水饮料(碳酸饮料) | CO2能溶于水;且与水反应生成碳酸 |
⑤化工原料,制纯碱、尿素等 | 能与多种物质反应 |
3.二氧化碳对生活和环境的影响
(1)二氧化碳对人体健康的影响:二氧化碳本身没有毒性,但不能供给呼吸。
(2)温室效应:因为有了温室效应,地球表层温度才能适合人类生存。能产生温室效应的气体除二氧化碳外,还有臭氧(O3)、甲烷(CH4)、一氧化二氮(N2O)、氟氯代烷等。
(3)自然界中的碳循环:人和动植物的呼吸,煤、石油、天然气等化石燃料的燃烧消耗氧气,产生二氧化碳;而绿色植物等的光合作用吸收二氧化碳,释放氧气。
(二)一氧化碳
1.一氧化碳的性质
(1)物理性质:无色,无臭的气体,密度比空气略小,难溶于水。
(2)化学性质
①可燃性
②还原性
装置及说明 | 现象及注意事项 |
A处的现象是:黑色粉末逐渐变成光亮的红色。 反应方程式:CO+CuO △ Cu+CO2 B处的现象是:澄清石灰水变浑浊。 反应方程式:Ca(OH)2 + CO2 = CaCO3↓+ H2O C处的现象是:气体燃烧,发出蓝色火焰。 反应方程式:2CO + O2点燃2CO2 |
③毒性
课题3 二氧化碳的实验室制取
(一)实验室里制取二氧化碳的化学反应原理
1.试剂的选择:稀盐酸和石灰石(或大理石)。
2.反应的化学方程式:CaCO3+2HCl==CaCl2+H2O+CO2↑
(1)实验室不能用稀硫酸代替稀盐酸制取CO2,是因为硫酸与碳酸钙反应生成的硫酸钙是微溶物,会覆盖在石灰石或大理石的表面,阻止反应继续进行。
(2)不能用浓盐酸代替稀盐酸制取CO2,是因为浓盐酸挥发性强,挥发出的HCl气体会使制得的CO2不纯。
(3)不宜用碳酸钠粉末代替石灰石或大理石制取CO2,是因为反应速率太快,不便于收集气体。
(二)实验室里制取二氧化碳的步骤
步骤 | (1)连接装置,检查气密性 | (2)加入固体试剂 | (3)加入液体试剂 | (4)收集并验满 |
示意图 | ||||
操作及注意事项 | 用弹簧夹夹紧乳胶管,向长颈漏斗中加水至漏斗内形成一段水柱,若水柱高度保持一段时间不变,说明装置气密性良好 | 将锥形瓶横放,用镊子将石灰石(或大理石)放在锥形瓶口,再把锥形瓶慢慢竖立起来 | 长颈漏斗下端要在液面之下,形成“液封”,目的是防止生成的气体从长颈漏斗口逸出 | 收集:向上排空气法; 验满:将燃着的木条放在集气瓶口,若木条熄灭,则已集满 |
(三)实验室里制取气体的一般思路和方法
1.发生装置 (选择依据:反应物的状态和反应条件)
固固加热型 | 固液常温型 | ||||
高锰酸钾制氧气 | 稀盐酸和大理石(石灰石)制二氧化碳 | ||||
试管口略 向下倾斜 | 适合制取 少量气体 | 适合制取 大量气体 | 长颈漏斗可随时添加液体药品,注意下端管口液封 | 分液漏斗可控制加入液体的速率,从而控制反应速率 | 注射器可控制加入液体的速率,从而控制反应速率 |
改进装置的优点:可实现固液的分离和接触,从而控制反应的开始和停止。
开始:打开弹簧夹,液体从长颈漏斗流下,淹没过石灰石,反应开始 | 开始: 打开弹簧夹 | 开始:打开弹簧夹,液体淹没固体 | 开始:将铜网浸入溶液中 | 开始:打开弹簧夹 |
停止:夹紧弹簧夹,液体由于气体压强回流回长颈漏斗,液体液面低于隔板固液分离,反应停止 | 停止: 关闭弹簧夹 | 停止:关闭弹簧夹,液体压入左侧 | 停止:拉动铜丝离开液面 | 停止:关闭弹簧夹 |
2.收集装置 (选择依据:气体的溶解性和气体的密度)
排水集气法 | 向上排空气法 | 向下排空气法 |
适合气体溶解度小 不与水反应的气体 | 适合密度比空气大 不与空气反应的气体 | 适合密度比空气小 不与空气反应的气体 |
注意事项:导管口出现连续均匀的气泡时开始收集;集气瓶口有大量气泡往外冒时气体收集满 | 注意事项:导管伸入集气瓶底部。 以保证排尽集气瓶中空气。 | 注意事项:导管伸入集气瓶底部。 以保证排尽集气瓶中空气。 |
①所有气体从短管进 ②V排出的水=V气体 为防止气体溶解在水中,水面放一层植物油隔绝二者; 集气瓶上端若有空气,不影响收集的气体的体积数据,但是影响收集气体的纯度 | 气体进入集气瓶后出现在装置下端 气体的验满在另一侧出气口 | 气体进入集气瓶后出现在装置上端 气体的验满在另一侧出气口 |

03 素养提升
(一)误认为“碳”就是“炭”。
“碳”表示元素或纯净物的名称,如二氧化碳由碳元素和氧元素组成;“炭”表示的物质是混合物,如木炭、活性炭等。
(二)误认为石墨在一定条件下转化为金刚石是物理变化。
石墨转化为金刚石是化学变化,因为石墨和金刚石中碳原子的排列方式不同,二者属于不同的物质,也就是说石墨在一定条件下转化为金刚石这个过程中有新物质生成。
(三)气体的鉴别和除杂
1.鉴别:二氧化碳和一氧化碳
2.除杂(括号内为杂质)
CO【CO2】方法:通入足量的石灰水(或氢氧化钠溶液)吸收原理:Ca(OH)2 + CO2 = CaCO3↓+ H2O
CO2【CO】方法:通过灼热的氧化铜原理:CO+CuO △ Cu+CO2
3.实验室制取的二氧化碳气体除杂和净化
装置 | 原理 |
盐酸具有挥发性,故制得的CO2气体中可能混有少量的HCl气体,一般可用饱和碳酸氢钠溶液除去CO2中的HCl气体。气体经过饱和碳酸氢钠溶液后,会有水蒸气混入,浓硫酸有吸水性,可用浓硫酸除去水蒸气,进行干燥 |
(四)碳和碳的氧化物转化关系
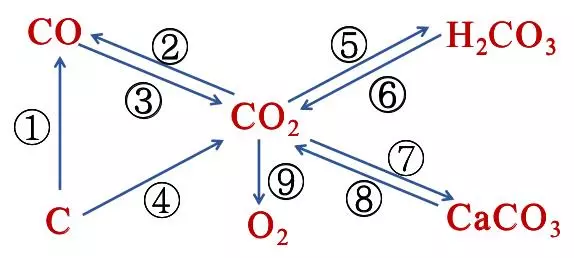
① C→CO:2C+O2点燃2CO C+CO2高温2CO
② CO2 →CO:C+CO2高温2CO
③ CO→CO2:2CO+O2点燃2CO2 CO+CuO △ Cu+CO2 3CO+Fe2O3高温2Fe+3CO2
④ C→CO2:C+O2点燃CO2 C+2CuO高温2Cu+CO2↑ 3C+2Fe2O3高温3CO2↑+4Fe
⑤ CO2→H2CO3:CO2+H2O === H2CO3
⑥ H2CO3 →CO2:H2CO3 === CO2↑+H2O
⑦ CO2 →CaCO3:CO2+Ca(OH)2 === CaCO3↓+H2O
⑧ CaCO3 →CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑ CaCO3高温CO2↑+CaO